倪海厦||正式论文区:手术化疗与放射线疗会对肿瘤加速扩散的研究
以中和抗体抑制肿瘤成长因子β 可避免因放射治疗引起的肿瘤加速转移nhx490
(Inhibition of TGF-β with neutralizing antibodies prevents radiation-induced acceleration of metastatic cancer progression)

期刊:
临床研究期刊 (The Journal of Clinical Investigation) Volume 117 Number 5 May 2007
作者
Swati Biswas,1 Marta Guix,2 Cammie Rinehart,2 Teresa C. Dugger,2 Anna Chytil,1
Harold L. Moses,1,3,4 Michael L. Freeman,5 and Carlos L. Arteaga1,2,4
单位
属于美国田纳西州 那什维尔 范德堡大学(Vanderbilt University)
1.癌症生物学系、2.医学系、3.病理学系、4. Vanderbilt-Ingram癌症中心乳癌研究计划 以及 5.放射肿瘤学系
译注1:此为放射性治疗。
译注2:此为一癌症化学治疗常用药物,俗称「小红莓」。
译注3:此为感染此病毒之初期的产生的三种T抗原中其中一种。
除Smad族的蛋白质外,TGF-β还可以刺激数种转化的讯息传递路径。之前TGF-β已被证实可保护转化细胞(transformed cells)不受细胞凋亡之害。此类细胞反应有一种可能的机制,就是TGF-β诱发了PI3K和PI3K的标的物,也就是丝胺酸/酥胺酸激酶 Akt,此讯息传递程序和对于癌症药物的抗药性是相关连的。有些对传统化学疗法有抗药性的肿瘤会过度表现TGF-β,而TGF-β的抑制剂经证明可逆转此种抗药性。还有,大部分的肿瘤都会过度表现TGF-β配体(ligands)。在肿瘤组织与在血清中的高量TGF-β配体,与肿瘤转移的复发、患者较差的愈后,均有所相关。
在乳癌的基因转殖模型中,TGF-β之讯息传递可加强转移既存的乳腺肿瘤。这是受例如Neu/ErbB2或多腺瘤病毒中央T抗原(polyomavirus middle T antigen,PyVmT)等的癌症基因之诱发所致。再者,在MMTV/LTR乳腺启动子的控制下,表现PyVmT癌症基因的基因转殖鼠,经过有条件的TGF-β1诱导,只要两个礼拜之短,转移肺癌的机率便高了十倍。有些癌症治疗已被证实会全面性地、或留在原处诱发TGF-β。所以我们推测,被癌症治疗所诱发的TGF-β,会提供存活讯息给这些对化疗有抗药性的肿瘤里的细胞,或者一部分此种肿瘤中的细胞,使它们可能在治疗之后,立即加速肿瘤的扩展。在此,我们使用了乳癌转移的MMTV/PyVmT 基因转殖模型来展示,游离辐射(ionizing radiation)和小红莓(doxorubicin)提高了循环中的TGF-β1浓度、循环中的肿瘤细胞数、以及肺部的癌症转移。这些效应都藉由TGF-β中和抗体的施加,而得以抵销。在缺乏第二型TGF-β受器(TβRII)的老鼠身上,放射线则没有增加肺部的癌症转移。这些资料暗示,癌症治疗所产生的TGF-β是肿瘤中一个帮助癌症转移的讯号,因此也提供了原理根据,使我们在使用这些疗法时,得以同时搭配使用TGF-β的抑制剂。
胸腔的放射线处理及化学治疗,会增加循环中的肿瘤细胞量与增加肺部癌症转移。TGF-β增强了会表现PyVmT肿瘤基因之肿瘤细胞的存活率,而且之前已被证实,TGF-β有条件地被诱发后,会在MMTV/PyVmT基因转殖鼠中加速乳腺肿瘤的转移。因此,我们推测,因治疗而提升的循环中TGF-β1浓度,可能和这个乳癌转移模型中的循环中肿瘤细胞增加、肺部癌症转移增加,有所关连。带有肿瘤的MMTV/PyVmT老鼠在第八周大时,被施行胸腔放射处理(thoracic irradiation)(10 Gy)直至第十三周为止。实验终结时进行心脏穿刺以取得血液,而血液中的细胞部分,则拿去测试其在活体外生成细胞集落之能力。从未经放射处理之老鼠所取得之血液,产生了平均1.6 ± 1.5个细胞集落;而从经过放射处理之老鼠所取得之血液,于10-12天后所测量的结果是,产生了平均28.3 ± 7.6个细胞集落(P=0.02:图二A)。PyVmT抗体的免疫染色证实,这些生长的细胞集落有表现癌症基因(图二A)。循环中的活肿瘤细胞数有所增加;而和此相符合的是,我们在经放射处理的老鼠中,观察到较未经处理之控制组17倍的肺部表面癌症转移(P = 0.009;图二B)。在被用doxorubicin处理相较于未处理之老鼠中,也在肺部癌症转移观察到类似的上升情形(P = 0.032;图二C)。在施加doxorubicin 24小时之后,相较于未经处理之控制组老鼠所取得之血液,也观察到在细胞群落数目的上升(17.2 ± 3.7与7.2 ± 2 colonies; n = 5; P = 0.007)。从老鼠的体重及一系列的肿瘤直径数据来看,受处理与未处理的老鼠在肿瘤负荷量上并无差异,这表示TGF-β1浓度之差别,不能简单地以肿瘤负荷量会随时间增加来解释。
接下来,我们检验了放射线所诱发之肺部癌症转移,是否仅限于带有肿瘤的MMTV/PyVmT基因转殖鼠身上。为了测试这个可能性,我们从会表现PyVmT之基因转殖的乳腺癌中,取得表现luciferase的肿瘤细胞,然后将其注射至非基因转殖的同源FVB老鼠身上。这些老鼠中的肿瘤,生长在左侧鼠蹊(inguinal)(四号)的乳腺脂肪垫,我们以生物发光法,观察并估计了其转移扩散至肺脏的情形(图三A)。当肿瘤长到了200mm3或更大时,老鼠在胸腔施加了10 Gy 的放射线并在其余部分施加屏障,两周后将老鼠牺牲。相较于控制组,接受放射处理的老鼠增加了三倍的表面肺部癌症转移(P = 0.005; 图三,B和C)。再者,在放射处理后24小时与两周之后,分别有相较于控制组多8倍与5倍的循环中肿瘤细胞量(表一)。在实验组与控制组间,原发肿瘤的生长率并无不同(资料未呈现)。
将培养中的PyVmT细胞暴露在1.25 - 7.50 Gy下,会增加其产生TGF-β的量(图四A)。在以上所述之研究过程中,有既成之肿瘤的老鼠才会施加放射线处理;循环中TGF-β浓度的增加,有可能是因为放射线在癌症细胞上的作用,因此我们想排除掉这个可能。我们对未交配的FVB母鼠施加了10 Gy的胸腔放射。在放射处理后一个小时,我们从尾部静脉注入了表现PyVmT 且受 luciferase 稳定转染(stably transfected)的肿瘤细胞。肺脏中的肿瘤细胞负荷量(tumor cell burden),是在肿瘤细胞的注入之后,使用活体内(in vivo)与活体外(ex vivo)的生物发光来监测的。经放射线处理的老鼠肺脏,表现了较控制组为高的生物发光讯号(图四B),此讯号与人工计数之表面肺癌转移数量是相关连的,亦与肺脏重量相关(图四,C与D)。
TGF-β中和抗体阻断了受放射线诱导增加之肺部癌症转移。我们使用了2G7中和泛TGF-β IgG2抗体 (2G7 neutralizing pan-TGF-β IgG2)来验证,放射线所诱导增加的循环中TGF-β浓度,是否在肺癌转移中扮演一个成因的角色。这个单株抗体阻断了所有三种哺乳类所具有的TGF-β异构物,并且在活体中有活性。八周大的MMTV/PyVmT基因转殖鼠,在胸腔放射处理的2小时之前,以15mg/kg 之2G7或PBS注射至腹腔中。这些处理持续每周两次,到第十三周为止,此时将老鼠牺牲并测量是否肺部有癌症转移。然而有趣的是,施打2G7到未经放射线处理的老鼠中,少许增加了肺癌转移,但在统计上并不显著(图五A和B)。在两种实验组别之间,并未存在原发肿瘤细胞负荷量的差异(资料未呈现)。
我们收集了血液并体外培养其细胞悬浮液,以估计在循环中的肿瘤细胞量。从未经放射处理与经过放射处理的老鼠身上,血液中取得而培养的细胞群落数,均因施加2G7而显著地减少(图五C)。最后,我们检验了在体外添加2G7以抑制TGF-β,是否会阻止老鼠血液中取得之肿瘤细胞群落生长。将带有肿瘤、经过放射处理的老鼠所取得之血液,接种于含有2G7与不含有2G7的环境下,而在十天之后评估其集落生长情形。将细胞培养在存有2G7的环境下,发现会降低70%的细胞群落数(图五D),这表示自泌性的(autocrine) TGF-β对于表现PyVmT的循环中癌症细胞,是一种存活因子。
放射线诱导增加肺部癌症转移,需要肿瘤细胞内的TGF-β受器。以上描述的结果显示,因放射线诱导之循环中TGF-β浓度提升,是对于循环中肿瘤细胞的存活信号,让细胞可以移居至肺脏、在肺脏里生长。因此我们推论,藉由移除细胞对循环中TGF-β的反应,以使得TβRII 不存在于MMTV/PyVmT肿瘤中,就可以抵销放射处理在癌症转移上的效应。为检验此推论之可能,我们使用了表现PyVmT的肿瘤细胞,并且用Cre-Lox技术将TβRII有条件地于细胞中移除。含有或未含TGFBR2的PyVmT表现型肿瘤细胞株(在此之后将称为PyVmT/TGFBR2flox/flox or PyVmT/TGFBR2KO)是分别从PyVmT/TGFBR2flox/flox 及 PyVmT/TGFBR2KO老鼠身上的乳腺癌所产生。PyVmT/TGFBR2flox/flox 及PyVmT/TGFBR2KO细胞株均以luciferase之载体稳定转染,且经由尾部静脉注射入八周大、未交配的FVB母鼠,这些母鼠有些没有经过放射线处理,有些则是在注射肿瘤细胞之前1小时,施加了10 Gy的胸腔放射。两周后估计肺部癌症转移情形。在被注射PyVmT/TGFBR2flox/flox 细胞的老鼠里,经放射处理之老鼠相较于控制组老鼠,发现生物发光讯号有所增加、肺部癌症转移增加6倍;但如果老鼠之前是被注射不含有TβRII的细胞,在施加与未施加放射处理的两组中,便没有差别(图六,A-C)。PyVmT/TGFBR2KO 的肿瘤结节比 PyVmT/TGFBR2flox/flox 的肿瘤结节还大,此结果与之前的一项报告是相符合的,也就是说,PyVmT表现型乳癌细胞之TβRII丧失,会增进肺部癌症转移的生长。经PCR扩增肿瘤组织中取得之DNA证实了在 PyVmT/TGFBR2KO细胞中,是存在基因重组的(图六D)。
讨 论
我们在基因转殖老鼠的乳癌转移模型中,研究了癌症治疗所诱发的TGF-β是否会加速肿瘤的发生。在MMTV/PyVmT基因转殖鼠中,在肺部施加游离辐射或是以doxorubicin处理,都增加了循环中的TGF-β1量、循环中肿瘤细胞数以及肺部癌症转移。循环中TGF-β1浓度增加、之后的癌症转移增加,并不需要老鼠在施加处理时就拥有肿瘤,就如同我们也在放射处理后才施打肿瘤细胞的老鼠中所观察到的。TGF-β1会增加,并不仅限于受到胸腔放射处理的诱导,因为我们在骨盆的放射处理、以及全面性施加doxorubicin下,也都观察到了TGF-β1的受诱导增加。在放射处理后,循环中肿瘤细胞的增加以及肿瘤转移的增加,都因到2G7的施加而抵销。重要的是,循环中PyVmT表现型肿瘤细胞无法在有2G7的环境下进行体外培养,这也就表示了自泌性(autocrine)TGF-β对这些细胞是一种存活的讯号。这些结果与之前两项研究是相吻合的;在这些研究中,以可溶性TβRII:Fc融合蛋白、或用反义TGF-β1(antisense TGF-β1)稳定性转染加以阻断TGF-β,都抑制了肿瘤细胞的能动性、存活率、渗入(intravasation)以及肺部癌症转移。
老鼠身上的肿瘤不含TβRII,放射线便无法在这些老鼠身上加强肺部癌症转移。为了展示此点,我们从PyVmT/TGFBR2flox/flox 与 PyVmT/TGFBR2KO之老鼠身上既成之乳腺肿瘤,取得细胞株来使用。Forrester等人曾经提出报告,以MMTV/Cre表现有条件地使TGFBR2缺失时,这些knockout PyVmT表现型的肿瘤发生潜伏期就变短了许多,并且表现出明显增加的肺部癌症转移,这是相较于PyVmT/TGFBR2flox/flox型的肿瘤。因为我们使用了静脉注射法,并且,我们所注入细胞株是从既成之含有TβRII与未含TβRII的肿瘤而来,所以我们的结果无法解释Forrester等人所报导之癌症潜伏与转移的表现。尽管我们在经放射处理的老鼠中无法排除TGF-β之增加,是否会影响宿主的微环境(microenvironment)与/或免疫系统,并进而帮助了肿瘤转移之进行,我们不含有TβRII之肿瘤的结果却强烈地显示,癌症转移之增加至少在部分上,是肇因于TGF-β在癌症细胞的直接作用。
在肿瘤细胞中,这些潜在受循环中TGF-β浓度调控的讯号反应,目前仍属未明。然而,TGF-β的助癌转移效应并不仅限于此基因转殖模型。举例说明,在MMTV/LTR启动子控制下表现有活性的TGF-β1与Neu的双基因型(bigenic)的老鼠,也表现出比MMTV/Neu更多的循环中肿瘤细胞与肺部癌症转移。会表现Neu和具活性的TGF-β1之乳腺肿瘤细胞,能侵入Matrigel并且能在transwells上移动,但却受可溶性的TβRII:Fc给阻断,表示单单Neu不足以诱导出一种侵略性的表现型。再者,在会表现具活性Neu的基因转殖肿瘤里,若共同表现具活性的突变种Alk5和TβRI,会增加肺部血管外的癌症移转(extravascular lung metastasis),这与TGF-β之效应相符:也就是肿瘤周围蛋白酶、癌症细胞的附着和侵略。PyVmT是一个强而有力的癌症基因,我们也已经知道它会活化ErK和PI3K;但2G7竟然能对如此的肿瘤细胞具备有效的抗肿瘤移转效果,有点不符合直觉。但是,这表示TGF-β可以放大癌症基因的讯号,而只要这讯号大于某一阈值,可以完全地使肿瘤移转被观察到;并且,相反地,在肿瘤基因已恶性转化的细胞(oncogene-transformed cells)内阻断TGF-β讯号时,会把这些讯号降低至比阈值更低的程度,使其无法到达癌症基因诱导癌症进行。确实如此,在鳞状细胞癌(squamous cancers)中被逼着表现的显性-具活性Smad2,已经被证实会和有活性的Ras共同作用,使不具侵略性的肿瘤转变成会转移的肿瘤;但Smad突变型不与TβRI结合,并会抑制乳癌细胞的转移。最后,在Ras经恶性转化的细胞中,显性-不具活性且被截短的TβRI表现之后,则是会抑制肿瘤的产生能力(tumorigenicity)以及癌症移转。
癌症治疗后的肿瘤再增殖(repopulation)与发展,是一众所皆知的现象。它已被证实会在放射治疗、化学治疗以及手术摘除后发生。(在参考文献37中有回顾)。TGF-β的浓度会对放射线有所反应而增加,也被发现与放射治疗后之肺脏受伤有关,这是由胶原蛋白沉积、肺泡壁的增厚以及内皮细胞受伤所致。放射线引起的肺脏组织伤害,会因为施以抗TGF-β抗体而显著地减少。在手术方面,已经有人提出,因为组织操作以及伤口复原而产生的生长激素过量释放,包括TGF-β的过量释放,会紧接着手术之后促进癌症移转。确实如此,手术之后,循环中随即发现了肿瘤细胞的存在,也发现肿瘤细胞数量的增加;而且在治疗性切除直肠癌两周之后,若循环中的TGF-β浓度居高不下,就表示癌症会很快地转移至肝脏。相反地,在手术刚切除直肠肿瘤后,血清中的TGF-β浓度却是显著地降低的。最后,以化学-放射治疗处理后期的头颈部癌症,以及以化学治疗处理非小型细胞肺癌(non-small-cell lung cancers)的情形下,循环中的TGF-β浓度已被证实和对治疗的反应相关。
在本研究中,我们展示了放射治疗与化学治疗会提升循环中的TGF-β浓度、循环中的癌症细胞数、以及癌症的移转。这些效应会因为系统性地施加2G7而被阻断,因此支持TGF-β为癌症转移进展之肇因的说法。这些数据有数个临床上的含意。第一,因癌症治疗而增加的循环中TGF-β浓度,应该要预前地探讨与监控,因为它可能是一种标记,代表肿瘤注定要在治疗之后快速地增长。第二,在循环中TGF-β浓度已被观察到增加的病人,其身上带有的肿瘤,可能会因我们施加TGF-β抑制剂而加强基本疗程的效果,也可能可以抵销与疗程相关的毒性效应,例如放射线引起的组织伤害以及纤维化。我们预期,以我们现存的方法以及尚在临床研发中的治疗用TGF-β抑制剂,这些假说在不久的将来可以被证实

TGF-β1的生物检测。貂肺脏内皮报告细胞(mink lung epithelial reporter cell)在PAI-1启动子控制下,稳定地表现萤火虫luciferase。这些细胞接种于12-well 培养皿上 (2x105/well)并且留置过夜供其贴附。已知浓度的可溶性TGF-β1或肺脏组织的细胞裂解液(250μg/well)加入了三次,而这些细胞被留在5%二氧化碳、37°C的环境下培养了另外24小时。在清洗之后,这些细胞被收取至200μg/well的裂解缓冲液中(Dual Luciferase Kit; Promega),luciferase的活性则是在依据厂商提供的实验步骤下进行了测量。
DNA萃取与聚合酶连锁反应(PCR)。以石蜡固定的肿瘤切片被取出和重新添加水分。趁着还潮湿的时候,肿瘤部分以经消毒之刀片刮取至经消毒的eppendorf管中。DNA萃取是使用Instagene (Bio-Rad)并依厂商提供的实验步骤所完成。DNA样本储存在-20°C,除非要另外使用。Cre诱导的PyVmT/TGFBR2KO肿瘤重组,是用PCR引子以及前述之反应条件下所验证的。
眼窝后(retroorbital)血液收集以及TGF-β1之定量。老鼠以1%-2% isofluorane麻醉。血液(约250μl/老鼠)采集于眼睛里的结膜静脉,作法是使用肝素化之Natelson tube (Fisher Scientific)然后再移转到肝素化的(heparinized)玻璃管中。血浆的制备是使用Ficoll-Paque Plus (Amersham Biosciences)并依照厂商之使用说明进行,且增加了一个步骤,即在4°C下以10000g离心十分钟以除去血小板。为测量PyVmT表现型细胞之培养基中的TGF-β1,1 x 106 的细胞被涂布在含在完全培养基的10 mm盘上,并且供其贴附。该培养基在隔天被更换成无血清之培养基。隔夜培养后,细胞被施以1.25-7.5 Gy。过72小时后,培养基经收集并以快速真空法浓缩(3 ml to 500μl)。老鼠的血浆和受细胞条件培养基(cell-conditioned medium),均在下一步的TGF-β1的Quantikine Elisa kit (R&D Systems)中接受测试,依照的是厂商提供的实验步骤。标准曲线以31.5–2,000 pg/ml的人类重组TGF-β1绘出后,被用来计算TGF-β在老鼠血浆与细胞培养基中的等量。每项标本都在另外的重制实验中重复检验了三次。
TGF-β2之定量。依照厂商提供之实验步骤,在酸活化之后,血浆标本以TGF-β2 Quantikine Elisa kit (R&D Systems)测试。标准曲线以31.5–2,000 pg/ml的人类重组TGF-β2绘出后,被用来计算TGF-β2在老鼠血浆的等量。每项标本都在另外的重制实验中重复检验了三次。
老鼠的放射处理。MMTV/PyVmT基因转殖老鼠或正常的FVB母老鼠(Harlan),在麻醉后把背部固定在镜台上。我们使用了单一的胸前辐射场,并使用了铅块掩护老鼠身体的其他部分。在某些实验中则是使用了一个单一腹部辐射场。老鼠被施加300 kVp 的X光,其剂量为 2.05 Gy/min。所有的老鼠都依照此法规Institutional Animal Care and Use Committee of Vanderbilt University Medical Center,被留在一个专门的无病原空间中。在动物暴露在放射线或其他处理后,喂食正常食物,并且详细观察是否有任何情绪不稳的迹象。
小红莓(doxorubicin)的处理。53天大的MMTV/PyVmT老鼠,经腹腔注射三次溶解于食盐水液中的doxorubicin (Adriamycin; 5 mg/kg; Sigma-Aldrich),每次间隔21天,直到第95天止。经无效空白试剂或小红莓处理之老鼠,其血液样本和肺脏组织,都于第107天解剖取得。为了要检查小红莓处理之后的循环中肿瘤细胞,经无效空白试剂或小红莓处理之老鼠,其血液在取得24小时后,又加入了单一剂量(5 mg/kg)。
侦测循环中肿瘤细胞。循环中肿瘤细胞之培养方法如前述,仅有少部分之修改。扼要地说,血液取得于心脏穿刺。细胞悬浮液(包括buffy coat以及红血球)从血浆中分离出后,接种在6-well盘上,这些盘上布有了生长激素减量之Matrigel (BD Biosciences),并添加有DMEM、10%FBS,之后便于37°C、5%二氧化碳之温箱中培养。隔天,在每个well使用了红血球移除缓冲液(4.15 g NH4Cl, 0.5 g NaHCO3, 0.0186 g disodium EDTA in 200 ml water)以及PBS,数次缓和的冲洗。DMEM与10%FBS(3ml/well)添加后,新鲜的培养基每三天将会补充一次。过了10-12天后,以人工计数大小为50μm以上之细胞集落。PyVmT表现是用免疫细胞化学方法来侦测的。扼要地说,吸出培养基、以PBS清洗wells,然后细胞集落以10%中性缓冲的福尔马林(formalin),在室温下固定30分钟,再用PBS清洗2次,再于室温下与PBS中之3%BSA共存1小时。培养盘接着培养隔夜,于4°C置放于含有生物素标记的抗PyVmT的老鼠单株抗体(diluted 1:500, BIOT-115L; Covance)。然后,加入与streptavidin结合之荧光二级抗体(Oregon Green 488; Invitrogen) 室温下1小时,之后使用Hoechst 细胞核染色法(1 μg/ml 十使用分钟)。免疫荧光是以Leica DM IRB 倒置显微镜所观察的。
生产反转录病毒载体以及细胞转导。MMTV/PyVmT细胞,是以luciferase之载体稳定转染的。一个luciferase cassette从pGL3-Basic (Promega)裁切下来,并嵌入pMSCV-puro (Clontech)之多重复制位上。amphotropic packaging Phoenix cells 转染后,产生感染性病毒颗粒,如前述。培养生长中(subconfluent)之癌症基因表现细胞,在4 μg/ml Polybrene (Sigma-Aldrich)中,以病毒上清液转导6小时,而含有病毒颗粒的培养基在6小时之后更换;在48小时后,再添加含有10%已经加热变性之FCS的DMEM,并于7-10天后将抗药的细胞集落合并。
肿瘤产生能力以及肿瘤转移之研究。在1%–2% isofluorane 之麻醉下,MMTV/PyVmT/Luc 细胞(2 × 106 cells in 200 μl PBS) 被注射于FVB母鼠的左侧四号乳腺脂肪垫。扼要地说,在注入肿瘤细胞之前,脂肪垫便已经以手术使其暴露在外,而伤口以干净夹子密合,并于10天之后取走。每周以生物发光法检查肿瘤两次,并系列地以测径器测量之。这些肿瘤的以立方公厘(mm3)计算之体积,是以此数学式计算:v = (w2 × l)/2,v代表体积,w代表宽度,l代表长度。当肿瘤达到了200 mm3或更大的体积(约两周时间),老鼠就被施以放射线处理,或是不作任何处理。老鼠继续每周两次接受生物发光法的监控观察,直到实验终结。两周之后,将老鼠牺牲并取得基本的肿瘤与肺脏。以解剖显微镜计算肺脏表面之癌症转移数,之后这些肺脏以10%中性缓冲之福尔马林(formalin)固定之。固定好的肿瘤切片,以H&E染色之,并以显微镜检查是否有肺癌之转移。血液是由心脏穿刺取得以如前述,测量TGF-β之浓度以及循环中之肿瘤细胞数。
在其他的情形里,我们使用了MMTV/PyVmT、PyVmT/TGFBR2flox/flox或PyVmT/TGFBR2KO细胞来表现luciferase。2.5 × 106 之单一细胞悬浮液制备后,重新溶于无菌之PBS液中。0.5 × 106 (in 200 μl)的细胞被注射入FVB母鼠之侧面尾部静脉中。静脉注射24小时后,肿瘤细胞于老鼠肺部之位置,以生物发光法确定之,并且自此之后每周追踪两次。为了要在活体内阻断TGF-β,在把10 Gy注入老鼠胸腔的前24小时,将15 mg/kg的2G7注入老鼠腹腔内,每周两次,持续进行,直到老鼠死亡。
生物发光法显影技术。要将生物发光之讯号与肿瘤负载量建立定量的对应关系,先以溶解于去离子水的 luciferin substrate (d-luciferin potassium salt; Promega)进行腹腔注射(0.15 mg/g body weight),在注射之后12分钟内取得影像。根据我们之前的时间记录之实验,在此时间记录讯号高峰处之强度(资料未呈现)。在取得影像时,将老鼠以isofluorane麻醉。生物发光显影是以Vanderbilt University Small Animal Imaging Center的 IVIS-200 显影系统 (Xenogen)完成的。我们采用了3-5分钟的整合计算时间,并使用on-chip binning of 8,以增加讯号-噪声比。生物发光显影之定量分析是以Living Image software (Xenogen)完成,我们在此定义了感兴趣区域(regions of interest,ROI)并测量了integrated photon counts。

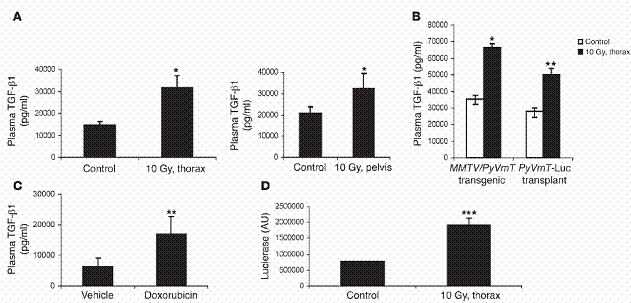
放射线与化学治疗增加循环中TGF-β1浓度。 (A) 10 Gy 的放射线被施加于FVB老鼠之胸腔(thorax) (左)或骨盆腔(pelvis )(右)。24小时之后取得血液,血浆中之TGF-β1浓度以在「方法」中所述测量。(B) 八周大、带有肿瘤之MMTV/PyVmT 老鼠,或非基因转殖之FVB 老鼠,在四号乳腺脂肪垫带有200mm3以上大小之肿瘤,不作任何处理或施加10 Gy 于胸腔。血浆中TGF-β1浓度,24小时后测量之。(C) 在第八周起,每隔21天,以空白试剂或腹腔注射小红莓 (5 mg/kg i.p.),处理基因转殖老鼠三次。血浆中TGF-β1浓度在第十五周测量之。A–C 之数据代表三个不同的独立实验,每组使用三个实验对象。(D) FVB老鼠胸腔被施加10 Gy。五周后,取得经放射线处理、控制组老鼠之肺脏,及其细胞裂解液(250 μg/ml),加到含有貂肺上皮细胞的triplicate wells,这些细胞会稳定地表现plasminogen activator inhibitor–1/luciferase reporter (PAI-1/luciferase reporter)。二十四小时后,测量luciferase之表现,方法如「方法」部分中所述。图示:*表示P P P
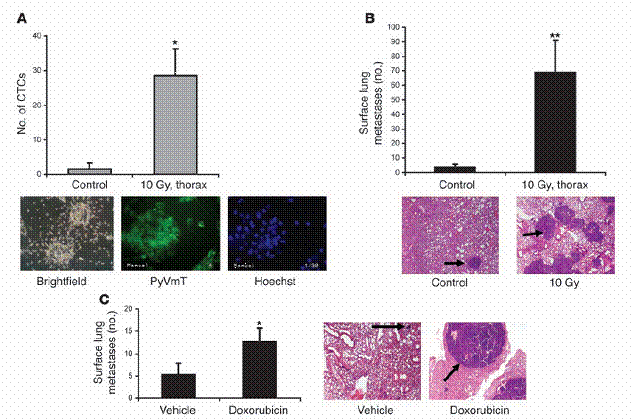
放射线与化学治疗增加循环中肿瘤细胞量以及肺部之肿瘤转移。(A) MMTV/PyVmT母鼠在八周大时,接受胸腔放射线处理。在第十三周时,当实验终结,以心脏穿刺取得血液,并量取其细胞悬浮液在体外产生细胞集落之能力,如「方法」中所述。CTCs代表循环中肿瘤细胞(circulating tumor cells)。在下面为一些具有代表性的影像,是由血液中取得、循环中单一个肿瘤细胞形成的细胞集落。基因转殖成功的细胞集落,用PyVmT抗体和荧光之次级抗体处理,并以荧光显微镜观察并估计之。(B) 与A 同样之老鼠,在第十三周大时计算肺部表面癌症之转移数目。A和B中之数据是代表三个独立的实验,每组中有四只老鼠。从控制组以及经放射线处理之基因转殖老鼠上,取得具代表性之 H&E 染色的肺部组织切片。这些切片是胸腔放射处理后五周所取得,如下方所示。黑色箭头所指为肺部癌症转移。(C) 八周大、带有肿瘤的 MMTV/PyVmT 基因转殖老鼠,每隔21天以空白试剂或腹腔注射小红莓(5 mg/kg i.p.)处理共三次。此实验于第十五周时终结,并计算肺部表面之癌症转移数量。具代表性之H&E染色肺部切片,其含有癌症转移部分的中心如右方图示。原始放大倍率为100倍。*表示P P
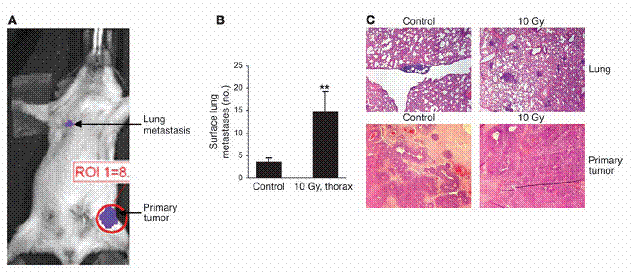
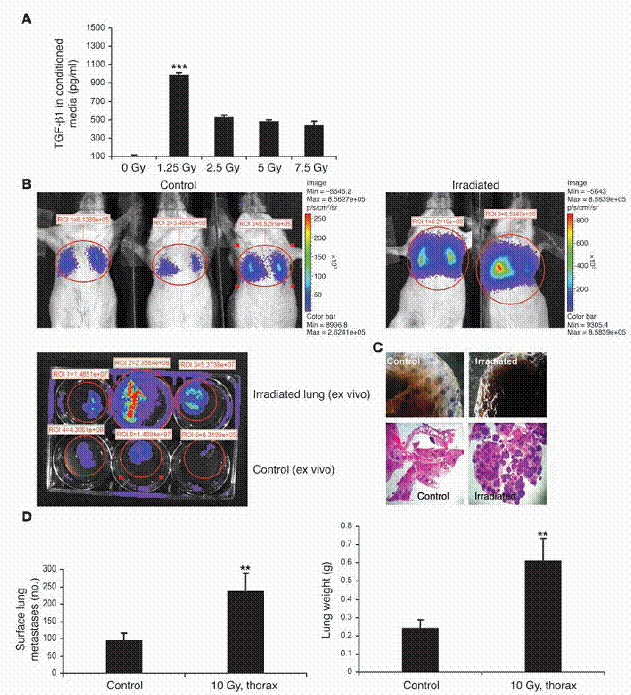
放射线的先行处理,会使移转的肺癌细胞更能够拓展在原本无肿瘤的老鼠身上。(A) MMTV/PyVmT 细胞,在加有不含血清之培养基之100-mm 培养皿里,以1.25–7.5 Gy处理。受细胞所影响之培养基在72小时后进行收集,并以如「方法」中所述之ELISA得知TGF-β1之浓度。(B) 稳定表现luciferase之MMTV/PyVmT 细胞,由尾部静脉注入未交配之FVB母鼠。在接受细胞注射1小时之前,老鼠在图中所标部分之胸部,以10 Gy处理之。在注射之后2周,肺部之癌症细胞以老鼠的生物发光法进行视觉观察(顶图)。某些情形中,肺脏在添加d-luciferin之后被手术移除,并于体外进行显影(底图)。控制组如左图所示,受放射线处理之老鼠如右图所示。(C) 具代表性的整体肺部载片(顶图)以及控制组与放射线处理组之H&E肺部切片(底图;原放大倍率为100)。(D) 在控制组与放射线处理老鼠中,肺部表面癌症转移之定量(左图)与肺部重量(右图)。数据为两个独立实验中,每组的五只老鼠的平均值±标准差。图示:**表示P P
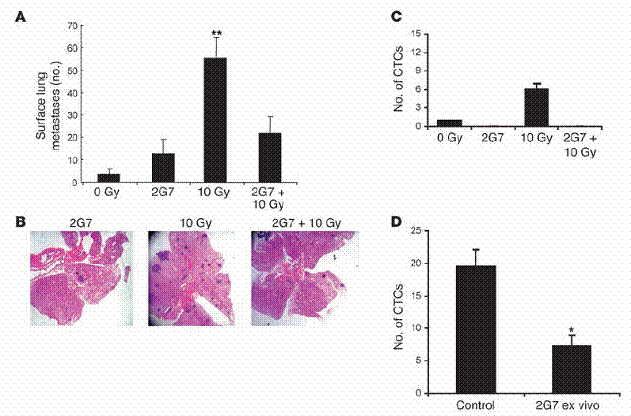
TGF-β中和抗体2G7,阻断了放射线诱导增加的肺部癌症转移。(A和B) 八周大、 带有肿瘤的MMTV/PyVmT老鼠于胸腔接受10 Gy处理。在图中标出之部分,老鼠被每周两次施以15 mg/kg 的2G7,直到第十三周。此时进行肺部表面之癌症转移计数。(A) 数据为每组中五只老鼠的平均值 ± 标准差。(B) 代表性的H&E 染色肺部切片。此实验重复一次取得了类似的结果。(C)当实验终结,以心脏穿刺取得血液,并量取其细胞悬浮液在体外产生细胞集落之能力,如「方法」部分中所述。(D) 在第十三周,经过胸腔放射处理、带有肿瘤的基因转殖鼠,收集血液。细胞悬浮液如C图中情形,在20 μg/ml 2G7或PBS环境下,涂布于培养盘上。10-12天后,人工计数等于或大于50 μm的细胞集落。数据为每组五只老鼠的平均值±标准差。*表示P P
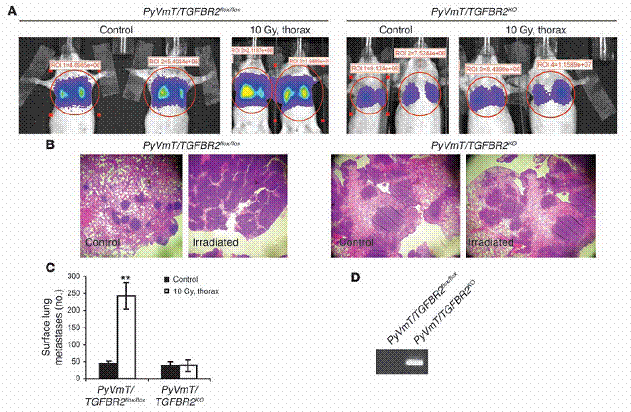
肿瘤细胞中不存在TGFβRII,能抵销受放射线诱发的肺部癌症转移之增加。(A–C) 未交配的、八周大的FVB母鼠,从尾部静脉注入稳定表现 luciferase的PyVmT/TGFBR2flox/flox 与PyVmT/TGFBR2KO 细胞。这些老鼠在注射肿瘤细胞之前,一组接受、一组未接受胸腔的10 Gy处理。两周后,以生物发光(A)、组织染色(B)、以及人工计数肺部表面癌症转移(C)的方法,来测定肺部表面癌症转移,如「方法」中所述。资料为每组中四只老鼠的平均值± 标准差。 (D) 两组细胞株的基因体DNA之PCR结果,显示重组片段的仅存在于PyVmT/TGFBR2KO细胞中。**表示P
译者:Jeffrey Chu at Hsinchu, Taiwan. 2009/4/4
不免有所遗漏、错误,敬请参考与指正,谢谢!
倪 师 评 论
过去我一直强调,西医的化学治疗不但无效于各种癌症,反而癌症病人会因为这化学治疗,让原本的癌细胞扩散到其他内脏去,自然病情就会越来越重,等于是加速癌症病人的快速死亡,我知道这种状况一直在发生中,因为这是我的临床经验告诉我的事实,任何中医师只要知道如何使用内经中的阴阳辨证法则来做诊断法的依据,也就是说对人体内的阴阳消长非常了解的医师,都可以知道我说的是对的,多年的治癌经验告诉我,西医学所谓的正统癌症治疗法如开刀、化学治疗、放射线治疗等,不但无助于治疗癌症,反而癌症病人因为这些不当与过度的治疗,让生活质量变成如人间地狱般的痛苦,如果病人能够忍受这些痛苦,而代价是多活几年,这也还罢了,但是事实却不是这样,所有的临床证据跟美国最新的癌症研究,现在都证明了,西医的三种必杀的治癌方法,只会让癌症病人寿命活得更短,完全没有证据证明,这些所谓正统的治疗方式,可以延长病人的寿命,这种超烂的医学治疗法,现在还被台湾的西医在沾沾自喜中,自命是正统的治疗,对中医学还不屑一顾,我个人认为只要是对病人有利的,我们就不该反对,Why not? 对不对,但是我必须要说实话,因为现在在台湾每年都在上升的癌症病患指数,证明了台湾在医学方面已经走错方向,这个方向再不做修正,未来还会有更多的可爱台湾人民,痛苦又快速的死于癌症,请问读者们,如果我不出面说明,谁敢出面说出这些真话呢?
上面是美国对癌症治疗的研究报告,放射治疗与化学治疗反而会加速癌症的快速扩散,希望台湾民众因此而觉醒过来,不要再沉迷于西医的癌症治疗法了,请尽快找中医帮你们吧,如果找不到可以信任的中医师,可以来传真,表明你的真实身分,我来帮你介绍推荐吧。
同时,感谢这位网友的协助,将这篇原文翻译成中文,以便让读者可以很轻易的阅读这篇研究报告,只有大家同心协力,才有机会将最正确的医学讯息传播出去,让世间所有的病人都能得到最好的医疗照顾,我们都很期这一天的到来,我替所有支持我们经方家的网友们,跟您说声谢谢,谢谢你替大家辛劳的付出,我心中能说的只有感谢再感谢!
谨记于佛州2009年03月22日
整理:月如玉、谢逸创
编辑:上善若水
免责声明:
图片、文字一些信息来源于网络空间,若侵权,请联系撤换。
音频、视频中、文中所有的医案、治疗方案和手法、药物基于专业中医个案辩证,请读者谨慎采用,若采用后果自负。《岐黄圣贤智慧》公益平台及相关人员不承担任何法律责任。
郑重声明:
转载请注明出自《岐黄圣贤智慧》公益平台,注明编辑名字,部分资料来源于网络,分享学习资料仅用于,转发转载不可用于谋利、不可插入广告等商业信息,否则将追究法律责任。
————《岐黄圣贤智慧》公益平台法务团队
